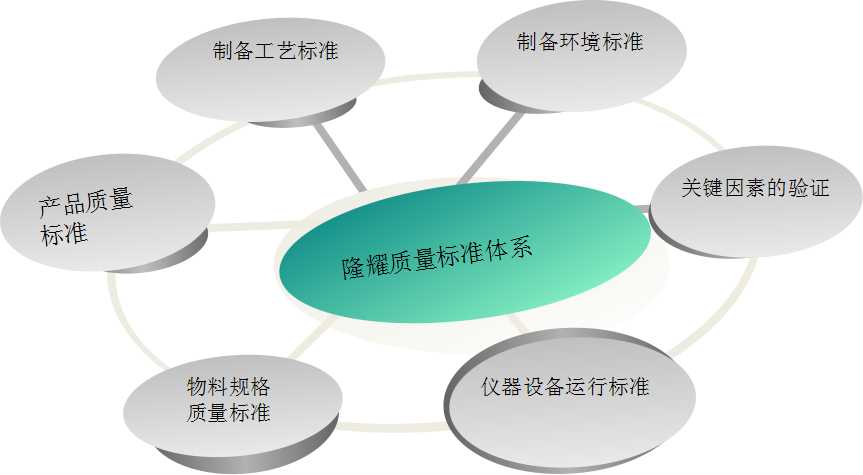
隆耀生物團(tuán)隊(duì)具有多年在制藥、細(xì)胞制劑領(lǐng)域的質(zhì)控管理經(jīng)驗(yàn),曾參與主持多項(xiàng)認(rèn)證,包括美國AABB體系、ISO9001、GMP認(rèn)證等,完善完備的對各項(xiàng)關(guān)鍵點(diǎn)進(jìn)行有效監(jiān)控,保障產(chǎn)品質(zhì)量。
參考標(biāo)準(zhǔn)Reference Standard
GMP
美國AABB
國家食品藥品監(jiān)督管理局2003 年制訂的《人體細(xì)胞治療研究和制劑質(zhì)量控制技術(shù)指導(dǎo)原則》
衛(wèi)生部2009 年制訂的第三類醫(yī)療技術(shù)管理規(guī)范《自體免疫細(xì)胞(T 細(xì)胞、NK 細(xì)胞)治療技術(shù)管理規(guī)范》
美國FDA 1998年制訂的《人體細(xì)胞治療和基因治療指導(dǎo)原則》
GMP
U.S. AABB
Guideline for human cellular clinical research and reagents quality control, 2003, SFDA.
Ministry of Health develop a third class medical technology management practices therapeutical techn-ical management standard of autologous immune cells (T cells, NK cells) , 2009, Department of Health
Guidance for Human Somatic Cell Therapy and Gene Therapy, 1998, US FDA